作者:郑宇璁、石焜
近日,我校生物反应器工程全国重点实验室郁惠蕾教授、许建和教授团队和上海交通大学赵一雷教授,在酶催化机制解析领域取得重要进展。研究成果以“Flipping of a Non-productive Substrate Binding Conformation Facilitates Hydroxynitrile Lyase Catalyzed Hydrocyanation”为题,发表于 Angewandte Chemie International Edition ,并被选为“Very Important Paper”。
该研究突破了传统蛋白质工程领域主要聚焦于活性中心几何优化的策略,提出了通过调控底物通道内构象翻转来提升催化效率的全新工程范式,并通过计算模拟定量揭示了突变降低翻转能垒的机制,为理性设计高效生物催化剂提供了创新思路。
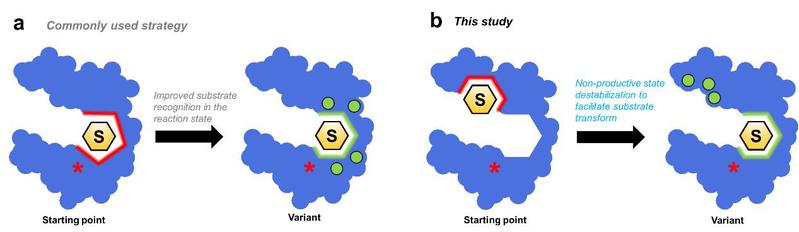
手性氰醇是合成β2-肾上腺素受体激动剂药物的关键前体。羟腈裂解酶虽能催化其形成,但对1,3-二氧六环并苯甲醛类底物催化效率极低。研究团队前期通过L331A突变拓宽了底物通道,但催化效率相比于天然底物仍有较大差距。为探究根源,该研究运用X射线晶体学与分子动力学模拟,首次在PcHNL5L331A突变体中发现了一种“倒置”的非生产性底物结合状态。该状态下,底物醛基无法与催化中心正确结合,阻碍反应进行。研究表明,高效的催化循环依赖于底物从“非生产性”向“生产性”结合状态的构象翻转。基于此发现,研究团队成功获得了三重突变体PcHNL5L331A/S333V/P340L,不仅通过S333V突变直接消除了稳定非生产性构象的氢键,还通过P340L突变间接增强了关键残基Phe72构象的柔性,从而共同促进了底物向生产构象的高效翻转。最终在双相反应体系中,突变体催化转换数高达36,000次,并保持>99%的对映选择性,已成功应用于克级规模合成高光学纯度的药物中间体。
该论文是私拍
私拍
博士研究生郑宇璁在郁惠蕾和许建和教授的指导下完成,计算部分由上海交通大学赵一雷教授团队完成,研究工作得到了上海有机化学研究所洪然研究员的指导。该研究工作得到了国家自然科学基金、国家重点研发计划及上海市科学技术委员会等项目的大力支持。
原文链接: //onlinelibrary.wiley.com/doi/10.1002/anie.202515778